Гипоплазия позвоночных артерий ГПА является частым анатомическим дефектом позвоночных артерий, и сейчас появляются данные, свидетельствующие о том, что она способствует возникновению хронической ишемии заднего отдела кровообращения. Однако взаимосвязь между ГПА и ишемическим инсультом остается мало изученной.
Гипоплазия позвоночной артерии может вызывать симптомы хронической ишемии в заднем отделе кровообращения головного мозга.
🟨 Боль в шее и мышечные спазмы по всему телу и сбивающий врачей с толку диагноз.
🟨 Нечеткое, расплывчатое зрение, звон или шум в ушах.
🟨"Мигрени" и головные боли напряжения, сопровождающиеся болью в шее, которые не снимаются лекарствами.
Целью данного исследования было определить распространенность гипоплазии ПА у пациентов с диагнозом острого ишемического инсульта, которые наблюдались в неврологической клинике, и определить, может ли она потенциально быть фактором риска развития атеросклеротического стеноза и хронической ишемии в области вертебро-базилярного кровообращения.
В это исследование были включены 609 пациентов с диагнозом острого ишемического инсульта в период с 1 января 2019 года по 1 января 2022 года. Были оценены демографические данные пациентов, факторы риска, рентгенологические и клинические характеристики.
У пациентов с гипоплазией ПА очень часто встречалось ишемия заднего отдела кровообращения мозга, и наиболее частыми локализациями атеросклеротического стеноза были сегменты V1 и V4 позвоночной артерии и средний сегмент базилярной артерии.
Анализ факторов риска развития атеросклеротического стеноза у пациентов с острым ишемическим инсультом заднего отдела кровообращения позволил предположить, что гипоплазия позвоночной артерии является независимым фактором риска.
Результаты исследования свидетельствуют о том, что гипоплазия ПА предрасполагает к развитию атеросклеротического стеноза в области вертебро-базилярного кровообращения, хотя его механизм остается неизвестным.
Параметры гемодинамики, связанные с атеросклерозом, не могли быть измерены in vivo. Таким образом, для лучшего понимания лежащего в основе механизма необходимо проведение исследований, изучающих параметры кровотока с помощью магнитно -резонансной ангиографии высокого разрешения у пациентов с диагнозом острой ишемии головного мозга, у пациентов с гипоплазией ПА.
Ключевые слова: острый ишемический инсульт, церебросервикальный атеросклеротический стеноз, гипоплазия позвоночной артерии
1. Введение
Позвоночные артерии являются основным источником артериального снабжения структур задней черепной ямки.[1]
Гипоплазия позвоночных артерий является частым анатомическим изменением позвоночных артерий, и из-за ее высокой распространенности было оценено клиническое влияние гипоплазии ПА.[2,3], данные свидетельствуют о том, что ГПА может вызывать ишемию заднего отдела кровообращения, хотя механизм, лежащий в ее основе, остается неясным.[2–4]
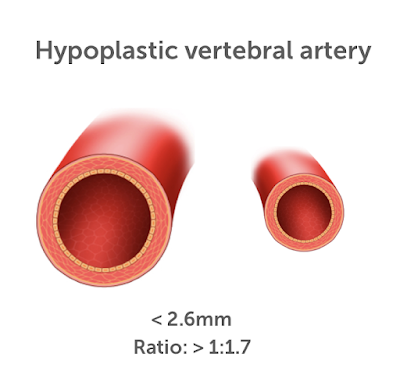
Гипоплазия позвоночной артерии определяется как диаметр позвоночной артерии с разницей более 1 мм (сегмент V4). [5] Асимметрия VAG была выявлена с помощью нескольких протоколов исследований; однако существуют ограниченные исследования, касающиеся литературы, которая постоянно описывает асимметрию или гипоплазию и определяет клиническую значимость гипоплазии ПА.[6,7]. Существуют ограниченные протоколы исследований, рассматривающие механизм ишемии головного мозга у пациентов с ГПА. Тем не менее, является ли гипоплазия ПА независимым фактором риска для хронической ишемии или только фактором риска, только в сочетании с другими атеросклеротическими факторами риска и механизмом хронической ишемии ГМ, остается неясным.
Связана ли взаимосвязь между гипоплазией ПА и хронической ишемии с полом, возрастом пациента или дополнительными факторами риска?
Ишемическая цереброваскулярная болезнь представляет собой гетерогенную группу заболеваний, вызываемых различными механизмами.
Целью данного исследования было определить распространенность гипоплазии ПА у пациентов с диагнозом острого ишемического инсульта, которые наблюдались в неврологической клинике, и определить, является ли гипоплазия ПА фактором риска развития атеросклеротического стеноза вертебро- базилярного отдела кровообращения.
2. Материалы и методы
Это ретроспективное исследование было проведено с целью определения взаимосвязи между гипоплазией ПА и атеросклеротическим стенозом вертебро-базилярного отдела кровообращения у пациентов с диагнозом острого ишемического инсульта в неврологической клинике Университета Улудаг. Исследование было одобрено Комитетом по этике медицинского факультета Университета Улудаг. Для этого исследования не требовалось согласия пациента.
2.1. Пациенты
В исследование были включены 609 пациентов с диагнозом "острый ишемический инсульт" и хроническая ишемия ГМ после неврологического обследования и нейровизуализации на медицинском факультете Университета Улудаг, отделение неотложной помощи. Из 609 обследованных 241 были женщины (39,6%) и 368 мужчин (60,4%). Возраст пациентов варьировался от 28 до 93 лет, со средним возрастом 66 (15 ± 11,77) лет.
Критериями включения были следующие: поступление в отделение неотложной помощи Университета Улудаг в течение 24 часов после очагового неврологического дефицита, или диагноза острого ишемического инсульта после нейровизуализации, определение этиологического фактора инсульта и регулярное 3-месячное наблюдение после инсульта в неврологической клинике Университета Улудаг. Критерии исключения были следующими: повышенный уровень мочевины-креатинина, патологии почек, пациенты, наблюдавшиеся в другом исследовании, пациенты, у которых компьютерная томография головного мозга и шеи была невозможна, неполное обследование для выяснения этиологии инсульта и хронической ишемии.
Все пациенты были осмотрены неврологом, а затем госпитализированы после проведения первичной компьютерной томографии черепа (КТ) и было начато соответствующее лечение. Для определения этиологии инсульта были выполнены шейная КТА, магнитно-резонансная томография черепа, контрольная КТ черепа, электрокардиограмма, эхокардиограмма, 24-часовой ритм по холтеру и, при необходимости, диагностическая церебральная ангиограмма.
2.2. Сбор данных
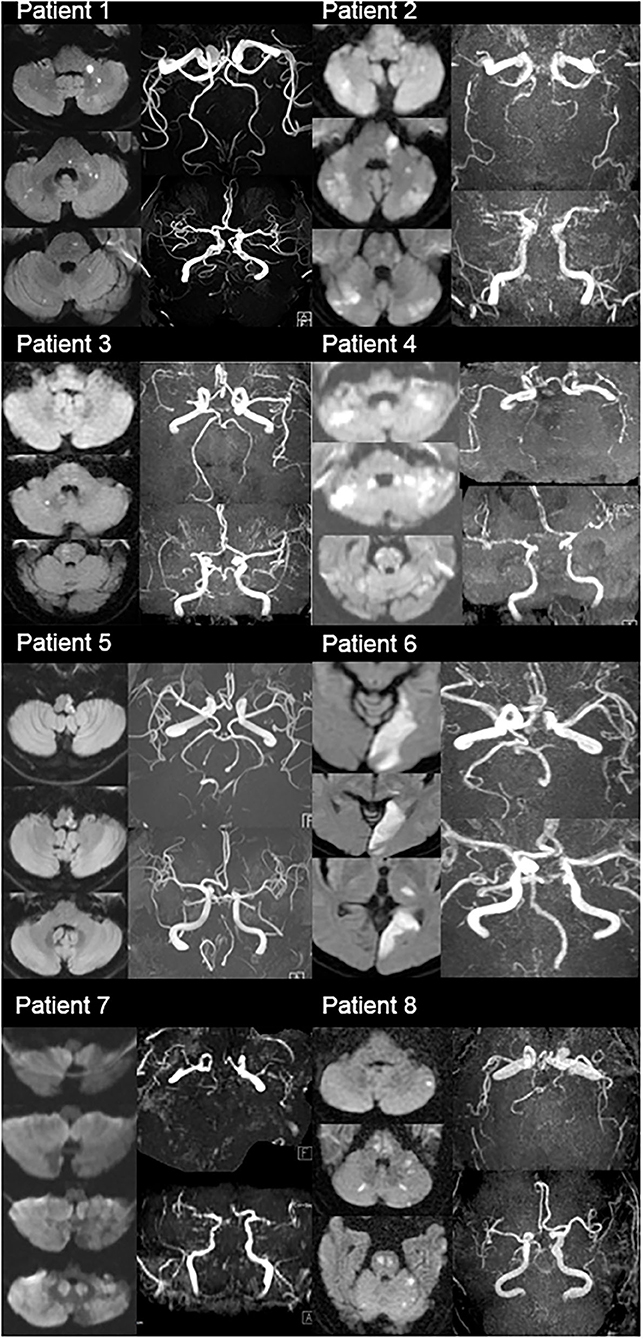
Данные, включая возраст, пол, время появления симптомов, историю болезни (история инсульта), гипертонию (АГ), ишемическая болезнь сердца, сахарный диабет (СД), сердечную недостаточность, фибрилляцию предсердий (ФП), порок клапанов сердца, печёночную или почечную недостаточность и прием лекарств, были занесены в регистратуру больницы и эпикриз пациента. Из 659 пациентов с диагнозом "острый ишемический инсульт", которые наблюдались в нашей неврологической клинике, 609 были включены в исследование в соответствии с критериями включения и исключения. Из 50 пациентов, исключенных из исследования, КТА головного мозга и шеи не удалось выполнить у 27 пациентов, этиология инсульта не могла быть определена у 10 пациентов из-за неполной оценки, а остальные 13 пациентов нерегулярно наблюдались в клинике неврологии Университета Улудаг в течение 3 месяцев после инсульта. Невролог использовал исследование Org 10172 в классификации лечения острого инсульта (TOAST) для определения этиологии инсульта. Рентгенолог оценил КТ-ангиографию и измерил разницу в диаметре обеих позвоночных артерий в сегменте V4, и у тех, кто превышал 2 мм, была диагностирована гипоплазия ПА[5]
2.3. Протокол CTA
Исследования проводились с использованием 128-секционного много-детекторного КТ-устройства Somatom Definition AS+ (Siemens, Эрланген, Германия). С использованием томограммы были получены изображения в плоскости короны. Также были получены не контрастные изображения в осевой плоскости от дуги аорты до вершины. Затем был взят низко дозированный аксиальный срез (предварительный мониторинг) на уровне дуги аорты. Область, представляющая интерес, была размещена в просвете дуги для метода отслеживания на этом срезе. Не ионное йодсо-держащее контрастное вещество (иогексол 300 мг) вводили кубитально в венозную систему с помощью автоматического устройства для инъекций в дозе 1,5 мг/кг со скоростью 5 мл/с и промывали физиологическим раствором в той же дозе. Во время инъекции были получены аксиальные срезы, повторяющиеся каждую секунду, с того же уровня при предварительном мониторинге.
Болюсное отслеживание выполняли непрерывно с помощью измерений в единицах Хаунсфилда на срезах для мониторинга. Когда значение единицы Хаунсфилда превышало 70 в области интереса, были получены изображения артериальной фазы с той же толщиной среза, количеством и плоскостными характеристиками не контрастной компьютерной томографии. Кроме того, было выполнено цифровое вычитание не контрастных изображений из изображений артериальной фазы с использованием модуля Neuro-DSA в программе Syngo CT Workplace (Siemens, Эрланген, Германия) для удаления кости и получения изображений-источников CTA. На не контрастных изображениях и изображениях артериальной фазы толщина среза составляла 0,6 мм без зазора, доза 120 кВ и ядро реконструкции H 10f. Ток в трубке определяли с помощью модуляции тока в трубке на основе ослабления (CARE Dose). Значения индекса объемной дозы КТ (CTDIvol) составили 0,09 мГр на томограмме, 20,88 на не контрастных изображениях, 2,53 при предварительном мониторинге, 5,06 при мониторинге и 26,97 на изображениях артериальной фазы.
2.4. Оценка изображения
Для оценки изображений использовали исходные изображения гипоплазии ПА. Передний отдел кровообращения описывает области головного мозга, снабжаемые ветвями внутренних сонных артерий.[8]
Задний отдел кровообращения состоит из 2 позвоночных артерий, базилярной артерии, 2 задних мозговых артерий и их ответвлений.[9]
Позвоночная артерия разделена на 4 сегмента: V1, V2, V3 и V4. V1 простирается от начала до входа в позвоночное отверстие C6, V2 простирается от позвоночного отверстия C6 до выхода из отверстия C2, V3 простирается от выхода из позвоночного отверстия C2 до твердой мозговой оболочки, а V4 простирается от твердой мозговой оболочки до вертебр-обазилярное соединение.[10]. Основную артерию оценивали в 3 сегментах: проксимальный сегмент, который простирается от вертебробазилярного соединения до начала передних нижних мозжечковой артерии; средний сегмент, который простирается от начала передних нижних мозжечковой артерии до начала верхних мозжечковой артерии; и дистальный сегмент, который простирается от начала верхних мозжечковых артерий до его дистального конца.[11 ]
Наличие атеросклеротического стеноза во внутричерепных сосудах пациентов оценивалось рентгенологом по методу NASCET. Позвоночные и базилярные артерии регистрировались в сегментах, указанных с помощью bt angio, на предмет наличия атеросклеротического стеноза. Пациенты были вызваны для контроля через 1 месяц после выписки, и модифицированная шкала Рэнкина была оценена в неврологической амбулатории 3 месяца спустя для определения клинического результата
2.5. Статистический анализ
Были сопоставлены рентгенологические, демографические и клинические данные пациентов. Статистический анализ проводился с использованием пакетной программы IBM SPSS Statistics 25.0 (IBM Corp., Армонк, Нью-Йорк). Для определения нормальности данных были применены тест Колмогорова-Смирнова, гистограмма и график Q-Q. После описания нормальности, средних значений и стандартных отклонений, или медиан (25-75%), они были подвергнуты непрерывным переменным. Частоты и процентные соотношения рассматривались как категориальные переменные. Для определения однородности дисперсии был применен тест Левена. Для анализа различий между группами по непрерывным переменным использовали 2-сторонний независимый пробный T-тест или 2–сторонний U-тест Манна-Уитни. Для анализа различий между группами по категориальным переменным были использованы двусторонний критерий точности Фишера, критерий хи-квадрат Пирсона и критерий коррекции непрерывности для таблиц (2×2) или (r×c). Для определения факторов риска атеросклеротического стеноза заднего отдела кровообращения был применен бинарный логистический регрессионный анализ. Значение P <0,05 считалось статистически значимым.
3. Результаты
Гипоплазия ПА была распространена у 37% пациентов с диагнозом острого ишемического инсульта. Из 225 пациентов с гипоплазией ПА 133 были правосторонними, в то время как остальные 92 были левосторонними. Правосторонняя гипоплазия наблюдалась у 20,3% пациентов по сравнению с левой у 9,8%. Кроме того, гипоплазия ПА чаще наблюдалась у мужчин (21,8%), чем у женщин (15,1%) (P = 0,01).
Такие факторы, как принадлежность к мужскому полу (P = 0,01) и курение (P = 0,008), часто были связаны с гипоплазией ПА. Другие клинические характеристики, такие как возраст, АГ, СД, заболевание коронарных артерий, модифицированная шкала Рэнкина, хороший клинический исход, ФП и уровень липопротеинов низкой плотности (ЛПНП), не показали статистически значимых различий (P > 0,05).
Пациенты с гип (n = 225) Пациенты без ВАГ (n = 384) Значение P
Средний возраст ± SD 66.14 ± 10.85 66.15 ± 12.29 .737
Пол (мужской)† 151 (%67.1) 74 (%19.2) .01
Гипертония† 177 (%78.6) 295 (%76.8) .599
Сахарный диабет† 90 (%40) 149 (%38.8) .770
Курение† 103 (%45.8) 134 (%34.9) .008
Заболевание коронарных артерий† 45 (%20) 81 (%21) .748
Уровень ЛПНПсреднее значение ± SD 128 ± 42.77 122.31 ± 35.94 .109
Рецидив инсульта† 49 (%21.7) 52 (%23.1) .012
Фибрилляция предсердий† 58 (%25.7) 127 (%33) .059
Инсульт переднего отдела кровообращения† 142 (%63.1) 293 (%76.3) .001
Инсульт заднего отдела кровообращения† 98 (%43.5) 98 (%25.5) <.001
Атеросклеротический стеноз переднего отдела кровообращения† 105 (%46.6) 117 (%30.4) .001
Атеросклеротический стеноз заднего отдела кровообращения† 82 (%36.4) 19 (%4) <.001
Краниоцервикальный атеросклеротический стеноз† 145 (%64.4) 134 (%34.8) <.001
Клинический исход (хороший клинический исход)† 161 (%71.5) 283 (%73.6) .566
Этиология ТОСТ-инсульта†
Атеросклероз крупных артерий 111 (%49.3) 96 (%25) <.001
Кардиоаортальный 57 (%25.3) 137 (%35.6)
Окклюзия мелких сосудов, 30 (%13.3) 81 (%36)
Другая определенная этиология 3 (%1) 17 (%4.4)
Неопределенная этиология 24 (%10.6) 53 (%13.8)
Стенозирующий сегмент позвоночной артерии
V1† 28 (%12.4) 8 (%0.2) <.001
V2† 13 (%5.7) 4 (%0.1) .001
V3† 9 (%4) 2 (%0.05) .002
V4† 45 (%20) 11 (%2.8) <.001
Стенозирующий сегмент базилярной артерии
Проксимальный сегмент† 4 (%1.7) 0 (%0) .005
Средний сегмент† 8 (%3.4) 1 (%0.4) .004
Ростральный сегмент† 3 (%1.3) 1 (%0.4) .120
Открыть в отдельном окне
Пациенты были классифицированы в соответствии с классификацией TOAST; этиологией инсульта у 207 пациентов был атеросклероз крупных артерий, кардиоэмболия у 194 пациентов, окклюзия мелких сосудов у 111 пациентов, другие определенные причины у 20 пациентов и неопределенная этиология у 77 пациентов. Наблюдалась значительная разница между этиологией инсульта и ВАГ (P < 0,001). Кроме того, у 101 (17%) пациента был диагностирован атеросклеротический стеноз в заднем отделе кровообращения. Были сопоставлены клинические, демографические и рентгенологические характеристики, и наблюдалась статистически значимая взаимосвязь между атеросклеротическим стенозом заднего отдела кровообращения и полом (0,026), СД (0,037), ФП (P < 0,001), ВАГ (P < 0,001), инсультом переднего отдела кровообращения (P < 0,001), ЧКВ (P < 0,001) и TOAST этиология инсульта (Р < 0,001). Однако, как указано в таблице Table2,2, не было статистически значимой связи
4. Обсуждение
Результаты этого исследования показали, что гипоплазия ПА является фактором, способствующим развитию атеросклеротического стеноза в заднем отделе кровообращения, и наиболее поражёнными сосудистыми сегментами были V1 и V4 позвоночной артерии и средний сегмент базилярной артерии.
Анализ факторов риска развития атеросклеротического стеноза заднего отдела кровообращения у пациентов с острым ишемическим инсультом показал, что гипоплазия ПА является независимым фактором риска.
Распространенность гипоплазии ПА , о которой сообщалось в литературе, варьировала от 10,8% до 43,5%.[12–13] Это различие может быть связано с этнической принадлежностью и факторами методологии исследования. В предыдущих исследованиях сообщалось, что хроническая ишемия чаще встречалось у пациентов с гипоплазией ПА. [2–4,13] Однако инсульт представляет собой гетерогенную группу заболеваний, вызываемых многими сложными механизмами, и механизм, с помощью которого гипоплазия ПА вызывает ишемический инсульт, остается неизвестным. В этом исследовании предрасполагало к развитию атеросклероза в заднем отделе кровообращения, что приводило к ЧКВ.
Известно, что атеросклероз является хроническим фибро-пролиферативным, воспалительным системным заболеванием, поражающим в основном артерии среднего и крупного размера.[14]
Все факторы риска, выявленные при атеросклерозе, были системными нарушениями, и, хотя они, по-видимому, затрагивают все артерии, атеросклеротические бляшки имеют очаговую форму и не демонстрируют непрерывности.[15,16]
Механические силы, воздействующие на стенку артерии, могут быть отнесены к местным факторам, которые, в свою очередь, влияют на улучшение состояния при атеросклерозе и корректируют калибровку и морфологию сосудов.[17]
В дополнение к системным факторам риска, динамика жидкости и геометрия артерий играли важную роль в развитии атеросклероза,[18] указывая на то, что ассоциация местных факторов в сосудистых структурах была не менее важной. На структуры кровеносных сосудов кровью воздействовали 2 основные силы: трансмуральное давление, которое представляет собой радиальную силу, приложенную к эндотелиальных клеток внутреннего ряда стенки сосуда, и напряжение сдвига, которое представляет собой касательное трение в соответствии с направлением потока. Величину напряжения сдвига эндотелия (ESS) определяли по вязкости крови и скорости трения. Кровоток в частично прямых сосудах одинакового диаметра был ламинарным, а значение ESS - нормальным. Было продемонстрировано, что физиологические значения ESS являются атеро-протекторными, а низкие или высокие значения были атерогенными исследованиями. Атеросклеротические бляшки также были расположены в областях, где напряжение сдвига было меньше или больше нормы, таких как ветви артерий, боковые стенки бифуркаций и искривления сосудов.[19–21]
Базилярная артерия берет начало от слияния двух позвоночных артерий. В отличие от нескольких системных артерий, которые имеют древовидный рисунок разветвления, базилярная артерия является единственной крупной артерией, в которой объединяются 2 артериальных потока. Первоначально постоянный поток в модели плоского соединения показал, что ESS находился ниже боковой стенки основной артерии с той же стороны, что и доминирующая позвоночная артерия, и эта территория с низким ESS увеличивает размер основной артерии. Проведенная аутопсия показало, что при наличии разницы в диаметре между позвоночными артериями толщина бляшек в боковой стенке базилярной артерии была больше, чем в доминирующей позвоночной артерии.
Это различие в толщине бляшек в базилярной артерии указывает на роль гемодинамики в прогрессировании атеросклероза.[22] Исследование с использованием MRA высокого разрешения показало, что характеристики кровотока (скорость и распределение ESS) в вертебро-базилярной системе здоровых молодых людей описывают как геометрию, так и соответствующую скорость кровотока в системе.[23]
Другие исследования показали, что динамика кровотока описывает возникновение и прогрессирование артериосклероза.[24,25]
Некоторые исследования показали, что Виллизиев круг и примыкающие к нему артерии защищают мозговую артерию и гематоэнцефалический барьер от гемодинамического стресса.[26] Согласно этой гипотезе, считалось, что некоторые изменения в вилизиевом круге влияют на объемные скорости кровотока в двусторонней внутренней сонной артерии и базилярной артерии у здоровых людей и прогрессирование атеросклероза.[27,28]
В этом исследовании атеросклеротический стеноз чаще встречался в переднем отделе кровообращения у пациентов с гипоплазией ПА , что может быть связано с вариациями в круге Уиллиса. Ангиографические данные показали, что существуют этнические различия в распределении кранио-цервикального атеросклеротического стеноза у пациентов с ишемией головного мозга.[29]
Хотя точный механизм, касающийся того, как гипоплазия ПА вызывает развитие атеросклероза в заднем отделе кровообращения, остается неизвестным, это исследование показало, что гипоплазия ПА вызывает развитие атеросклероза только в определенных сегментах заднего отдела кровообращения.
Факторы риска кранио-цервикального атеросклеротического стеноза следует определять отдельно для всех сегментов артерии. Насколько нам известно, это было первое исследование, в котором изучалась взаимосвязь между атеросклеротическими сегментами заднего отдела кровообращения и гипоплазия ПА. Кроме того, мы полагали, что гистологическая структура внутричерепных и шейных артерий и факторы риска развития атеросклероза различны.
Например, некоторые параметры защищают внутричерепные артерии от атеросклероза, и этими защитными факторами могут быть некоторые вариации вилизиева круга , высокая анти-оксидантная способность внутричерепных артерий, низкая воспалительная реакция, защитный эффект спинномозговой жидкости и реактивность мозга.[30] Возможные гемодинамические причины повышенного атеросклеротического стеноза заднего отдела кровообращения у пациентов с гипоплазии ПА включают повышенную разницу давлений в зонах бифуркации у пациентов с гипоплазией ПА, более низкую скорость кровотока в гипо-пластичной позвоночной артерии, накопление клеточных элементов при значительном увеличении вязкости крови и контакт поверхности просвета в гипопластичном сосуде. Удлинение, увеличение в гипопластичном сосуде, снижение ESS в доминантном сосуде и базилярной артерии, и все эти гемодинамические факторы повреждают эндотелий.
Параметры гемодинамики, связанные с атеросклерозом, не могли быть измерены in vivo. Таким образом, чтобы лучше понять механизм, необходимо провести исследования, изучающие параметры кровотока с помощью магнитно-резонансной ангиографии высокого разрешения у пациентов с церебральной ишемией и гипоплазией.
Анализ : Юртаев Александр Иванович
Сокращения: AF = фибрилляция предсердий, CT = компьютерная томография, CTA = компьютерная томографическая ангиография, DM = сахарный диабет, ESS = напряжение сдвига эндотелия, HT = гипертония, LDL = липопротеины низкой плотности, PCI = ишемия заднего отдела кровообращения, TOAST = Исследование Org 10172 по лечению острого инсульта, ГПА = гипоплазия позвоночной артерии.
Список литературы
[1] Камперо А., Рубино П.А., Ротон А.Л., младший Спецлер Р.Ф., Джордж Б., Бруно М. Анатомия позвоночной артерии. Патология и хирургическое вмешательство вокруг позвоночной артерии. Париж: Springer; 2011. 29-40. [Google Scholar]
[2] Катсанос А.Х., Космиду М., Кирицис А.П., Джаннопулос С. Является ли гипоплазия позвоночной артерии фактором, предрасполагающим к ишемии головного мозга в области заднего отдела кровообращения? Всесторонний обзор. Eur Neurol 2013;70:78-83. [PubMed] [Google Scholar]
[3] Гайгалайте В., Вилимас А., Озерайтиене В. и др. Связь между гипоплазией позвоночной артерии и инсультом заднего отдела кровообращения. BMC Neurol 2016;16:118. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[4] Катсанос А.Х., Космиду М., Джаннопулос С. Гипоплазия позвоночной артерии при ишемии головного мозга заднего отдела кровообращения. Clin Neurol Нейрохирург 2013;115:1194-5. [PubMed] [Google Scholar]
[5] Чжуан Ю.М., Чан Л., Ву Х.М., Ли С.П., Чу Ю.Т. Клиническая значимость гипоплазии позвоночной артерии. Acta Neurol Тайвань 2012;21:01-7. PubMed] [Google Scholar]
[6] Чжуан Ю.М., Хван Ю.К., Лин К.П., Лю Сай. К дальнейшему разъяснению: роль гипоплазии позвоночной артерии при мигрени с аурой. Eur Neurol 2008;59:148-51. PubMed] [Google Scholar]
[7] Чатурведи С., Луковиц Т.Г., Чен В., Горелик П.Б. Ишемия на территории гипопластичной вертебробазилярной системы. Неврология 1999;52:980-3. PubMed] [Google Scholar]
[8] Kumral E, Topcuoglu MA, Onal MZ. Синдромы переднего отдела кровообращения. Handb Clin Neurol 2008;93:485-536. PubMed] [Google Scholar]
[9] Истон Д.Дж., Фаучи А.С., Иссельбахер К.Дж. Фаучи А.С., Лонго Д., Каспер Д.Л., Уилсон Д.Д., Мартин Дж.Б. Цереброваскулярное заболевание. Анонимный принцип внутренней медицины Харрисона. Нью-Йорк, Нью-Йорк: McGraw Hill; 1998. 2325-48. [Google Scholar]
[10] Каплан Л.Р. Инсульт Каплана: клинический подход. Издательство Кембриджского университета, 5-е издание edUK: 2016. [Google Scholar]
[11] Алемсегед Ф., Шах Д.Г., Диомеди М. и др. Прогностическая оценка окклюзии базилярной артерии при компьютерной томографии-ангиографии. Инсульт 2017;48:631-7. PubMed] [Google Scholar]
[12] Бакенхэм Т.М., Райт И.А. Ультразвуковое исследование экстракраниальной позвоночной артерии. Бр Дж. Радиол 2004;77:15-20. PubMed] [Google Scholar]
[13] Петерсон С, Филлипс Л, Линден А, Хсу У. Гипоплазия позвоночной артерии: распространенность и надежность выявления и оценки ее тяжести при магнитно-резонансной томографии. J Manipulative Physiol Ther 2010;33:207-11. PubMed] [Google Scholar]
[14] Ханссон Г.К. Воспаление, атеросклероз и ишемическая болезнь сердца. N English J Med 2005;352:1685-95. PubMed] [Google Scholar]
[15] Хед Т., Даунерт С., Гольдшмидт-Клермон П.Дж. Риск старения и атеросклероз: свежий взгляд на артериальный гомеостаз. Front Genet 2017;8:216. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[16] Порвал У., Ханделвал С., Джайн Д., Гупта С. Гистологическая классификация атеросклероза и корреляция с ишемической болезнью сердца: исследование, основанное на аутопсии. Ann Pathol Lab Med 2016;3:99-104. [Google Scholar]
[17] Хонг Дж.М., Чунг К.С., Банг О.О., Ен С.В., Джу ИС, Ха К. Доминирование позвоночной артерии способствует искривлению базилярной артерии и инфарктам перивертебробазилярного соединения. J Neurol Нейрохирургическая психиатрия 2009;80:1087-92. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[18] Зариньш К.К., Гидденс Д.П., Бхарадвадж Б.К., Соттиурай В.С., Мабон Р.Ф., Глагов С. Бифуркационный атеросклероз сонных артерий. Атеросклероз бифуркации сонной артерии. Количественная корреляция локализации бляшки с профилями скорости кровотока и напряжением сдвига стенки. Circ Res 1983;53:502-14. PubMed] [Google Scholar]
[19] Дракопулу М., Тутузас К., Микелонгона А., Тусулис Д. Статины и уязвимые бляшки. Curr Pharm Des 2018;23:7069-85. [Google Scholar]
[20] Аллахвердян С., Шаабане С, Букайс К., Фрэнсис Г.А., Бочатон-Пиаллат М. Судьба гладкомышечных клеток и пластичность при атеросклерозе. Cardiovasc Res 2018;114:540-50. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[21] Пандей С.С., Хаскард ДО, Хамис Р.Р. Разработка стратегии интервенционной молекулярной визуализации атеросклероза окисленных липопротеидов низкой плотности. Mol Imaging 2017;16:1536012117723788. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[22] Равенсберген Дж., Равенсберген Дж.У., Криджгер Дж.К., Хиллен Б., Хоогстратен Х.У. Локализующая роль гемодинамики при атеросклерозе в нескольких геометриях вертебробазилярных соединений человека. Артериосклеротический тромб Vasc Biol 1998;18:708-16. PubMed] [Google Scholar]
[23] Уэйкбек А.К., Гатенби Дж.К., Гор Дж.К. Гемодинамические характеристики вертебробазилярной системы проанализированы с использованием моделей на основе МРТ. PLoS One 2012;7:e51346. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[24] Сиау В.Л., Н.Г. Эй, Мазумдар Дж. Прогнозирование течения нестационарного стеноза: сравнительное исследование неньютоновских моделей со схемой разделения операторов. Med Eng Phys 2000;22:265-77. [PubMed] [Google Scholar]
[25] Слагер С.Дж., Вентцель Дж.Дж., Гейсен Ф.Дж. и др. Роль напряжения сдвига в образовании уязвимых бляшек, подверженных разрыву. Nat Clin Pract Cardiovasc Med 2005;2:401-7. [PubMed] [Google Scholar]
[26] Врселя З., Бркич Х., Мрденович С., Радич Р., Курич Г. Функция круга Виллиса. J Cereb Blood Flow Metab 2014;34:578-84. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
[27] Рутсонис К.Г., Стамбулис Э., Христодулаки М. Аномалии круга Виллиса и атеросклероз. Vasc Surg 1973;7:141-5. [PubMed] [Google Scholar]
[28] Харткамп М.Дж., ван Дер Гронд Дж., ван Эвердинген К.Дж., Хиллен Б., Мали WP. Коллатеральный кровоток в круге Уиллиса исследован с помощью магнитно-резонансной ангиографии. Инсульт 1999;30:2671-8. [PubMed] [Google Scholar]
[29] Куреши А.И., Каплан Л.Р. Внутричерепной атеросклероз. Lancet 2014;383:984-98. PubMed] [Google Scholar]
[30] Ритц К., Денсвил Н.П., Стам О.К., ван Лисхаут Дж.Дж., Деймен М.Дж. Причины и механизмы внутричерепного атеросклероза. Circulation 2014;130:1407-14. PubMed] [Google Scholar]